
VIRUS-Free™ 是一种利用转座子系统进行细胞稳转株的构建和筛选的技术,以替代慢病毒感染构建稳转细胞株的技术。其载体中包括了转座子的识别区域,在转座酶的催化下,将目的片段从载体上或者BAC分子上切割下来形成一个小环结构,并在基因组里面的固定序列位置进行插入,从而实现稳转。目前已经在CAR-T细胞治疗中得到较多的临床应用,并充分体现出其:低成本、高效率、基因表达稳定的特点。
| 技术流程图
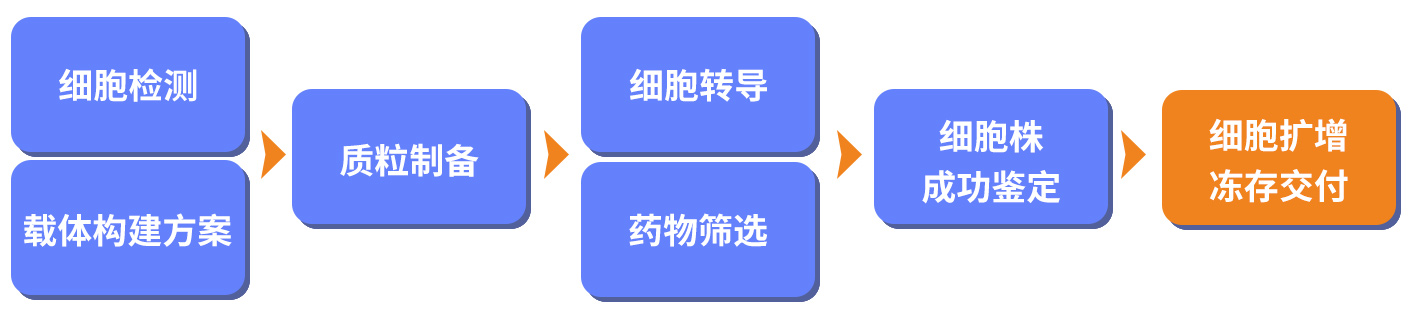
| VIRUS-Free™ 细胞基因稳转技术
2Kb以内基因插入(合成法)
插入片段小于2Kb的项目,我们将通过化学合成的办法获得质粒,并进行细胞转导,通过抗药性的筛选获得稳转克隆。
2-20Kb的基因插入(载体法)
插入片段2-8Kb的项目,我们将通过载体构建的办法来获得质粒,并进行细胞转导,通过抗药性的筛选获得稳转克隆。
Step1. 目的序列PCR扩增
Step2. 目的载体的构建获得表达载体
Step3. 目的细胞的转导和抗性药物筛选获得目的克隆
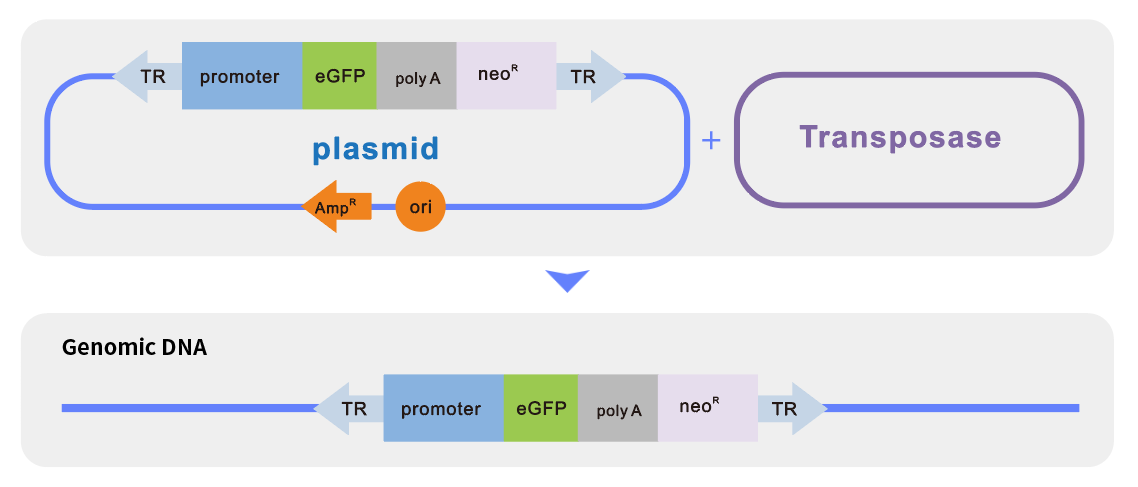
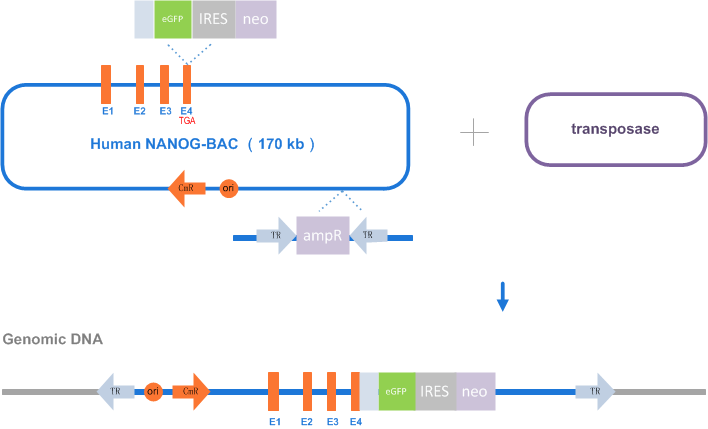
BAC片段细胞系稳转(BAC修饰)
通过Red重组系统对BAC进行遗传修饰获得重组BAC,并进行细胞转导,通过抗药性的筛选获得稳转克隆。
Step1. 目的序列PCR扩增
Step2. 通过Red重组获得经过遗传修饰的BAC
Step3. 目的细胞的转导和抗性药物筛选获得目的克隆
| 案例分析
VIRUS-Free™ 技术在构建稳转株中的应用
1. 实验目的
利用VIRUS-Free™ 技术构建表达荧光的稳转株,并验证所获得的细胞株的稳定性。
2. 实验用品
细胞:人结直肠癌细胞HCT116(Cas9X自有细胞库,经培养验证其生长状态、增殖速度、克隆形成率、电转阳性率等均良好)
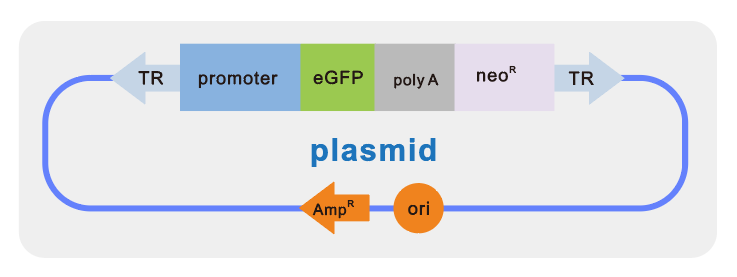
质粒:VIRUS-Free™ 构建的EGFP-Puro载体(结构如下图)
试剂:细胞培养相关试剂、电转液、多聚甲醛固定液
仪器:电转仪、NovoCyte Advanteon流式细胞仪(NovoExpress软件)
3. 实验步骤
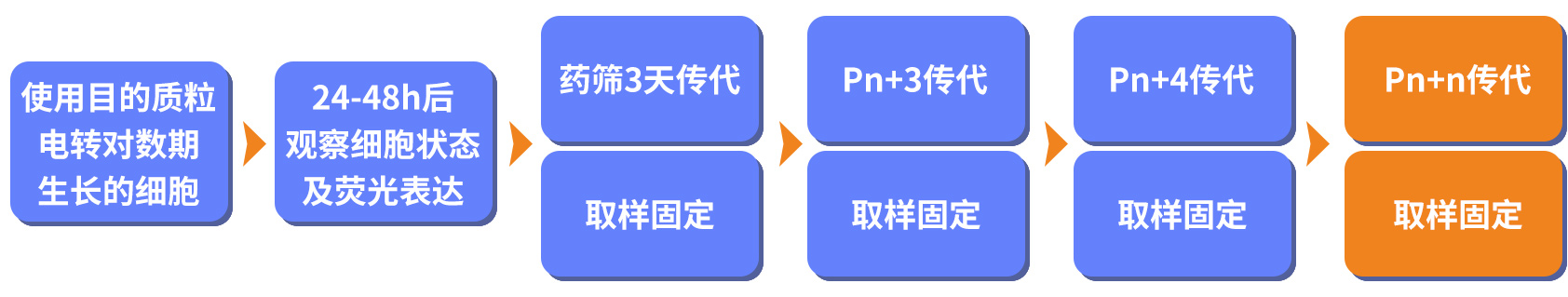
收集Pn/Pn+3/Pn+4……Pn+n,流式上机,对比各组GFP阳性率及强度
4. 实验结果
4.1 电转
按照适当比例,向备好的细胞样品中加入VIRUS-Free™ 质粒,充分混匀后对细胞进行电转。24h后观察荧光表达效果,GFP阳性率约50%。
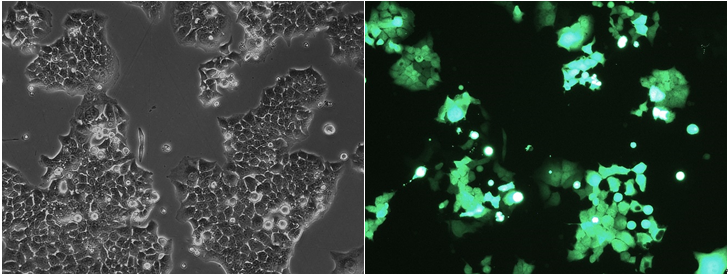
24h后镜下观察Pn细胞GFP表达
4.2 药筛
继续培养上述Pn细胞至48h,加入含一定浓度抗性药物puro的完全培养基,同时用该培养液培养野生型细胞作为对照组。3天后,对照组细胞已全部死亡,实验组细胞荧光表达良好,流式GFP阳性率95.72%。
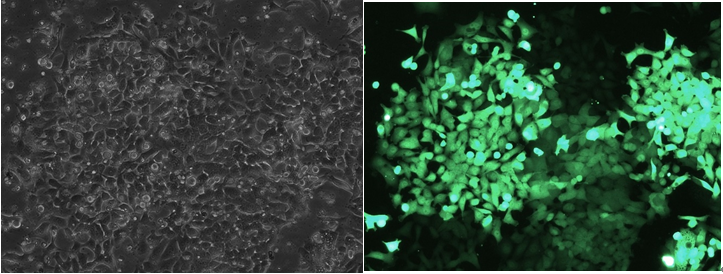
药筛3天后镜下观察Pn细胞荧光表达
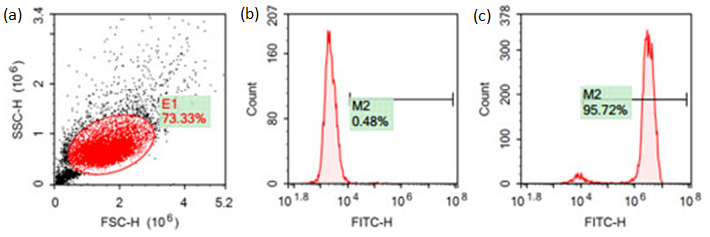
流式检测GFP阳性数据,(a)野生型散点图;(b)野生型直方图;(c)转染细胞直方图,GFP阳性率为95.72%
4.3 传代
将上述Pn细胞预留一部分进行若干次传代,传代过程中使用不含药物的培养基。
从Pn+3开始,每次传代均取样固定待测定流式,直到Pn+9结束传代,GFP均稳定表达。
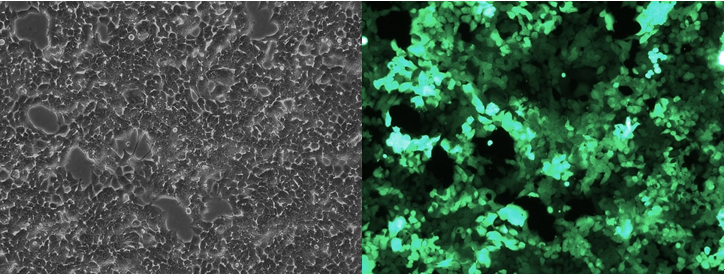
Pn+1细胞荧光表达
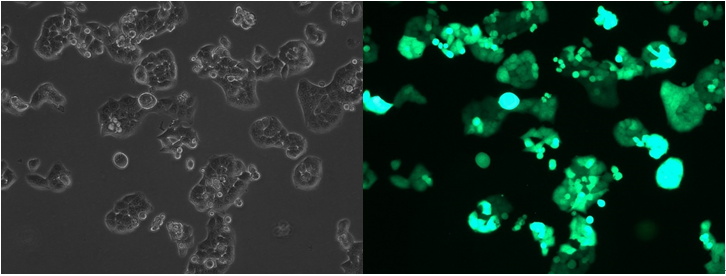
Pn+9细胞荧光表达
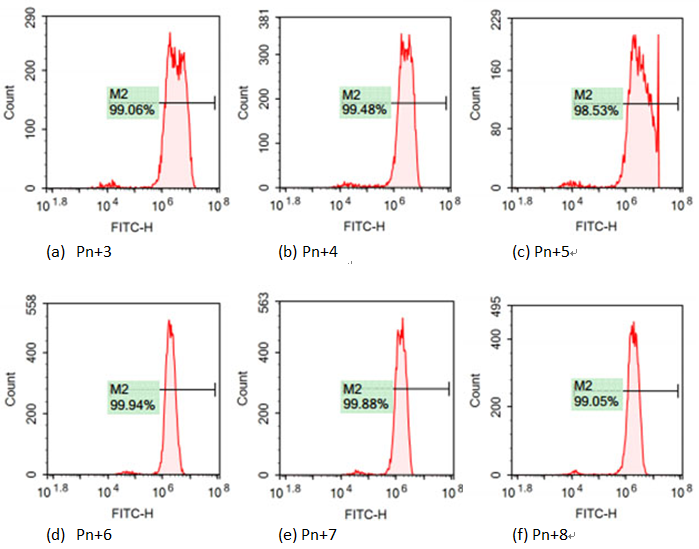
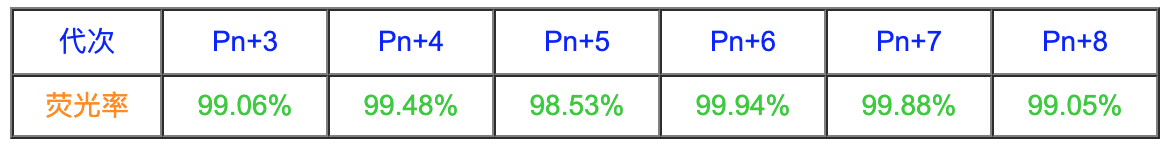
5. 实验结论
A. 利用VIRUS-Free™ 系统能够构建表达目的基因的稳转株;
B. 与常规质粒相比,VIRUS-Free™ 系统转导的细胞,显著表达时间为3-5天,时间因细胞而异;
C. 利用VIRUS-Free™ 系统获取的稳转株,经过药筛可稳定长时间高效地表达目的蛋白。
| 参考文献
1. Li R, Zhuang Y, Han M, et al. piggyBac as a high-capacity transgenesis and gene-therapy vector in human cells and mice. Dis Model Mech 2013;6:828-33.
2. Hou X, Du Y, Deng Y, et al. (2015). Sleeping Beauty transposon system for genetic etiological research and gene therapy of cancers. Cancer Biol Ther 16:8–16