

成骨诱导 诱导实验步骤
1. 培养容器包被,0.1%明胶在培养箱中孵育30分钟,
2. 接种诱导细胞:取对数生长期的细胞,按照2×10^4cells/c㎡的细胞密度接种至包被后的培养器皿中,于37℃,5% CO₂培养环境下培养至汇合度60-70%,弃掉上清,加入成骨诱导分化培养基。
注意事项:
(3)持续诱导至适量钙盐结节,并不是钙结节越多越好,建议在能看到细胞轮廓,上层有钙结节时终止诱导,覆盖在细胞上层一层灰状物质,染色后会出现红色。
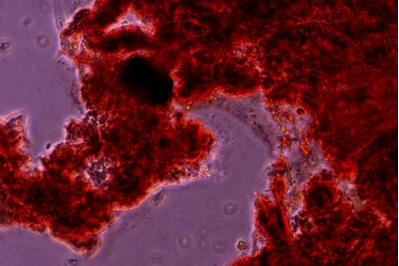
6. 诱导评估:显微镜下观察成骨染色效果,并进行图像采集和诱导评估。
诱导实验案例
案例1:MC3T3-E1 Subclone 14细胞成骨诱导分化实验
从克隆的但是表型各异的MC3T3-E1细胞系中分离出一系列亚克隆,从含抗坏血酸培养基生长的成骨细胞中选择高或低成骨细胞分化、矿化的亚克隆。MC3T3-E1 Subclone 14在抗坏血酸和3-4mM无机磷酸盐中生长表现出高水平的成骨细胞分化能力。

诱导结果:
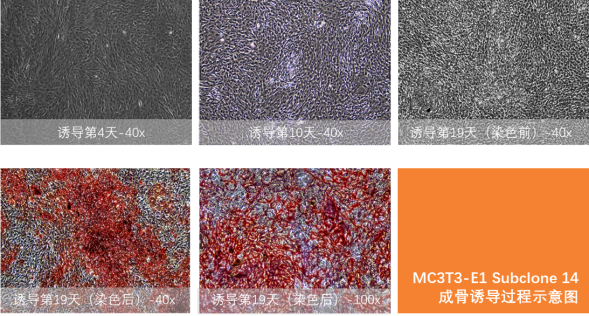

诱导结果:
常见问题
控制细胞汇合度、明胶包被
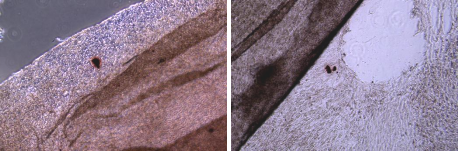
二. 许多碎片
可能是污染、或者是膜被吹散、培养基偏黄,没有及时换液导致。
1. 一般诱导过程会历时14-21天,甚至3周往上,实验组一直是处于操作的状态,是很容易有污染的风险,需要在无菌操作上更加注意。
2. 这些碎片也有可能是成膜的细胞导致的,当我们在操作换液的时候可能力度过大导致膜变成碎片。
三. 底部贴壁细胞出现收缩聚集现象,部分视野出现空斑,或者细胞飘了碎了
成骨培养基相对来说是比较温和的,但相对于完全培养基还是有一定刺激性,细胞可能会出现某个视野下没有细胞,某个视野下细胞比较聚集的情况,或者是很多细胞飘了,可能是诱导液对于细胞来说比较刺激,如果出现上述情况,可以换回完全培养基,待细胞状态稍稍恢复,再加入诱导液继续诱导。
四. 染色后的常见问题
1.异物
(1)染色前,尽量用无钙镁的PBS清洗干净,此外需要过滤茜素红,或者将茜素红进行离心。
3. 红色比较淡,背景比较白或者只有少量钙结节。
4. 染色不均
(1)可能是铺板密度不均,铺板不均匀可能导致分化不均匀、分化比例低、分化过程中细胞漂浮等问题。
