类器官(Organoid / Patient Derived Organoid, PDO)是经过体外3D培养,通过细胞自组装形成的微型三维细胞聚集体,它可以在很大程度模拟人体同类组织或器官的遗传特征和表观特征。作为一种新兴的前沿技术,类器官在人体组织器官的发育、稳态、生理和疾病机制、精准医疗、再生医学、药物筛选等领域都有广泛的应用前景。目前研究人员倾向于使用体外模型进行药物筛选和评估。除了避免动物实验的伦理问题,还可以缩短研究周期并降低成本,构建适当的体外模型能准确地反映体内环境,并在此基础上可以准确反映目的药物的药效学和药代动力学。
但在类器官实际构建过程中,我们或多或少会遇到一些问题,比如新构建的类器官长不起来,如何模拟体内环境,如何避免污染这些都是许多科研人想要解决的问题。

1. 组织样本:包括组织活性强度,组织量的大小,保存和运输条件。
2. 培养试剂:包括组织消化酶的选择,类器官培养基。
3. 操作手法:包括原代剪切手法和消化程度的辨别。
这几个因素决定我们是否能培养出类器官,类器官的量是多还是少。
由于组织活性不足而导致构建失败占了80%以上,我们在临床取样的时候更倾向于去取癌旁,癌组织边缘,因为这个部位的癌干细胞侵袭性强,活性比较高。往往经过了化疗或者放疗的患者的癌组织中间,纤维化,钙化程度较高,中心坏死细胞比较多,癌干活性低,不适合用于构建类器官。因此建议取未经化疗或者放疗的组织,转移性的癌组织也比较适合。例如要分离肝癌类器官,如果到手的组织是白色豆腐脑状,瘫软,发黑,这种组织不适合,因为由于肝癌增长过快,中心会因为缺血,缺营养导致组织坏死。一个好的肝癌样本,应该是组织边缘完整,没有糜烂的现象,色泽呈浅红或稍稍泛白。我们在镜下也可以将组织剪碎后放到皿中初步观察,假如镜下除了杂质外,都没有几个细胞,或者细胞发黑,碎片多,这种是肯定不适合构建类器官的。一个好的样本在镜下初步观察可以看到许多圆形细胞,在经过消化后,会呈现出多个细胞团。
第二个组织量的大小也有要求,一般手术样本的大小,至少有黄豆大小,如果样本很大,建议取肿瘤边缘的组织(非纤维化、非钙化、非坏死的组织),各个方向(上下左右)都建议取一块。如果是穿刺样本,建议至少要2cm以上,手术样本和穿刺样本都需要浸没到组织保存液中进行4℃低温运输。如果是新鲜的胸腹水,需要至少50mL的体积,并低温运输。时间控制在48小时以内,越早做成功率越高。
组织消化液的选择非常关键,如果用胶原酶Ⅱ、胶原酶Ⅳ,那么消化时间比较长,消化时间越长细胞活性越低。类器官的培养实际上是在培养成体干或者肿瘤干,这些干细胞的培养是要比普通原代提取是要难的,消化效果太强,干细胞活性受损,消化效果太弱,消化时间长对干细胞活性也不好,最好将消化时间控制在15-30分钟,对于比较硬的组织,例如肝胆管癌、食管癌,消化时间需要控制在1个小时以内。
第二个是培养基的选择,培养基的因子很多,如果按某一个文献的配方来做,这个配方可能有所保留,可能也养不好,需要结合多篇文献来摸索,但这个耗费的时间精力是巨大的,目前有商业化的培养基可供科研人选择,这些培养基是为研究某种类器官特定摸索研究得到的,可以节省科研人的时间成本。
组织清洗:在收到新鲜组织样本后,需要用原代缓冲液清洗3-5次以去除样本表面血液,在放入4℃预冷的组织保存液中保存运输。(如果样本前期保存不当会导致细胞活性差、污染、正常细胞少等问题,降低构建成功率。)接着将组织转移至洁净实验室进行组织处理和细胞分离,拍照并登记信息。准备多个60mm培养皿,往培养皿中加入4℃预冷的原代缓冲液备用。将组织放入培养皿中,原代缓冲液清洗3-5次,洗去杂质。剪切:使用眼科剪或手术刀将组织切割成体积约为1~3mm的组织块(建议放入1.5mL EP管剪碎组织)。对于较硬的组织可以剪得更细一点,更利于消化。组织在剪完以后也是会有细胞团的,不一定非要等到消化后在看,我们剪切好组织后,可以取样在显微镜下初步判断样本的好坏。消化:接着进行消化,往剪碎后的组织块中加入3mL(约组织体积3-5倍体积)的原代组织消化液(多加一点也没有关系),37℃摇床中震荡消化,消化过程中随时观察组织消化情况。10分钟后取少量消化液在显微镜下观察,当在镜下观察到较多的细胞簇或单个细胞后,加入3倍体积原代缓冲液终止消化,如果没有出现大量的细胞团,则继续消化。一般消化好后可以看到液体变浑浊。
过滤:终止消化后将所有液体通过100μm孔径的筛网过滤,将细胞滤液置于离心机中以300g离心5分钟,弃去上清,加入原代缓冲液再次重悬,再次300g离心5分钟后弃去上清。如果在这一步没有出现细胞沉淀,可能是由于离心力不够,或者是在过滤的时候细胞团没有吹下来,可以用多一点的缓冲液多次冲洗筛网上的细胞团,还有可能是离心结束后弃上清的时候直接倒掉了,一般建议用枪慢慢地把上清弃去,还有可能是没有消化好。如果细胞沉淀含有红细胞,弃上清后加入1mL红细胞裂解液,裂解1-2分钟后稀释至10mL,再次以300g离心5分钟。红细胞的存在会不利于类器官的观察,当红细胞量少时也可ui不进行裂红。
点胶加液:尽量去除上清,观察收集到的细胞沉淀体积量,添加25倍细胞沉淀体积的基质胶重悬(基质胶提前1天放4度冰箱融化,点胶时再把基质胶拿出来)充分混匀,并置于冷冻管架上保持0-4℃。基质胶对温度比较敏感,从加胶点样的时间需要把控,还有用基质胶重悬细胞团的时候,重悬的时间太久,会吹出很多气泡,而这些气泡会黏附在耗材上,会使类器官丢失。以24孔细胞培养板为例,每孔点25-30 μL组织基质胶混合物进行铺板。放入37℃培养箱中15-30分钟,等待基质胶凝固。每孔加750μL恢复至室温或预热的类器官培养基,置于37℃培养箱中培养。
原代操作过程中,要注意无菌操作,并确保使用的耗材无菌,使用的剪刀镊子需要进行高压灭菌,没有高压灭菌条件也要用酒精灯灼烧,用酒精棉球进行擦拭;运输过程中可以往组织保存液中加入1%PS。如果不幸出现污染,这个孔的类器官是一定要舍弃的。
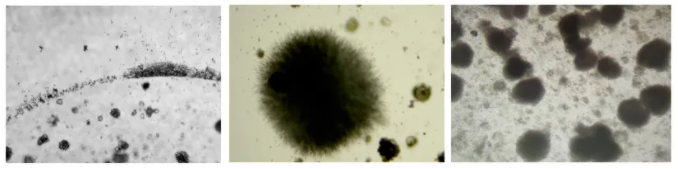
类器官污染
海星生物提供多种正常组织来源和对应肿瘤来源的类器官,作为专业的类器官研发和服务平台,海星生物提供的类器官极具稳定性,特定的类器官以及对应的生长培养基。为基础科研保驾护航。






